Säure-Base-Titration (Grundlagen)

in nur 12 Minuten? Du willst ganz einfach ein neues
Thema lernen in nur 12 Minuten?
-
 5 Minuten verstehen
5 Minuten verstehen
Unsere Videos erklären Ihrem Kind Themen anschaulich und verständlich.
92%der Schüler*innen hilft sofatutor beim selbstständigen Lernen. -
 5 Minuten üben
5 Minuten üben
Mit Übungen und Lernspielen festigt Ihr Kind das neue Wissen spielerisch.
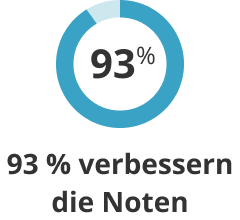
93%der Schüler*innen haben ihre Noten in mindestens einem Fach verbessert. -
 2 Minuten Fragen stellen
2 Minuten Fragen stellen
Hat Ihr Kind Fragen, kann es diese im Chat oder in der Fragenbox stellen.
94%der Schüler*innen hilft sofatutor beim Verstehen von Unterrichtsinhalten.
Grundlagen zum Thema Säure-Base-Titration (Grundlagen)
In diesem Video wird dir die Titration als quantitativ-analytisches Verfahren vorgestellt und erläutert. Zu Beginn wird dazu noch einmal auf die Neutralisation eingegangen, welche in der Säure-Base-Titration von besonderer Bedeutung ist. Danach wird die Apparaturen und das allgemeine Vorgehen bei der Titration beschrieben. Vor allem die Nutzung des richtigen Indikators ist hier besonders wichtig, welche im Vorfeld mit der Titration einer starken und einer schwachen Säure bzw. Base erläutert wird. Dabei wird auf zwei markante Daten in einer Titrationskurve eingegangen: den Äquivalenz- und den Neutralpunkt. Zum Abschluss des Videos werden dann exemplarische zwei Titrationsberechnungen durchgeführt. Wenn du mehr dazu erfahren willst, dann schau dir das Video an.
Transkript Säure-Base-Titration (Grundlagen)
Guten Tag und herzlich willkommen! In diesem Video geht es um die Säure-Base-Titration. Das Video gehört zur Reihe Säuren und Basen. Als Vorkenntnisse solltet ihr solides Wissen über Säuren und Basen mitbringen. Ihr müsst wissen, was Dissoziation, Neutralisation und ph-Wert sind. In diesem Video möchte ich euch grundlegende Vorstellungen über die Säure-Base-Titration vermitteln.
Der Film ist in fünf Abschnitte unterteilt: 1. Neutralisation und Titration 2. Titrationskurve 3. Äquivalenzpunkt und Neutralpunkt 4. Indikatoren und 5. Gehaltsbestimmungen
Neutralisation und Titration Wir haben gelernt, dass bei der Neutralisation, eine Säure mit einer Base zu einem Salz und Wasser umgesetzt werden. Ein Beispiel dafür: Salzsäure HCl reagiert mit Natronlauge NaOH zu einem Salz NaCl und Wasser H2O. Man kann die Reaktion aber auch so formulieren: Base + Säure -> Salz + Wasser. Im Beispiel bedeutet das: Natriumhydroxid NaOH reagiert mit Salzsäure HCl zum Salz Kochsalz NaCl plus Wasser H2O. Worin besteht der Unterschied zwischen der ersten Reaktion und der Zweiten? Im Erstfall kann ich so argumentieren, dass ich eine Säure zu einer Baselösung hinzugebe. Im zweiten Fall ist es umgekehrt. Hier wird eine Base zu einer Säurelösung gegeben. Das bedeutet oben, ich gebe Salzsäure zu Natronlauge und in der zweiten Reaktion unten, Natronlauge zu Salzsäure. Warum muss man zwischen diesen beiden Fällen unterscheiden? Wir haben es hier mit zwei unterschiedlichen Möglichkeiten der Titration zu tun, die wir heute besprechen werden. Bei der Titration handelt es sich um ein quantitatives Analyseverfahren. Man nennt die Titration auch Maßanalyse oder dem Lateinischen entlehnt Volumetrie. Was ist das nun, diese Titration? Ich möchte das mithilfe dieser zwei einfachen Versuchsanordnungen erklären. Wir haben auf beiden Seiten jeweils eine Bürette. Das ist ein graduiertes Rohr mit Auslaufvorrichtung. Durch die Betätigung des Hahnes unten kann die Flüssigkeit, die sich in der Bürette befindet, in das Becherglas einlaufen. Zum Durchmischen der Lösung ist im Becherglas ein Magnetrührer. In der Bürette links ist Salzsäure. Diese kann durch Öffnen des Hahnes, die Natronlauge im Becherglas neutralisieren. Bei der Versuchsanordnung rechts ist es umgekehrt. Hier ist Natronlauge in der Bürette und neutralisiert die Salzsäure im Becherglas. Die allmähliche Zugabe einer Säure zu einer Base bezeichnet man als Azidimetrie. Die allmähliche Zugabe einer Base zu einer Säure nennt man Alkalimetrie. Der Oberbegriff für Azidimetrie und Alkalimetrie ist Titration.
Titrationskurve Wir wollen in diesem Abschnitt die Titrationskurve für die Alkalimetrie untersuchen. Dabei betrachten wir zwei Möglichkeiten. In beiden Fällen wird mit Natriumhydroxid titriert. Beim linken Versuch wird Salzsäure neutralisiert. Salzsäure ist bekanntlich eine starke Säure. Rechts wird Essigsäure neutralisiert. Bei Essigsäure handelt es sich um eine schwache Säure. Schauen wir uns nun die beiden Titrationskurven an. Der ph-Wert der Lösung wird gegen die Menge der hinzugegebenen Natronlauge aufgetragen. Wir wollen nun den Verlauf der Titration für die Versuchsanordnung links verfolgen. Nun schauen wir uns die Titrationskurve für den Versuch rechts an. Die Titrationen sind beendet und wir haben die entsprechenden Titrationskurven erhalten. Was auffällt ist der Unterschied beim Übergang vom saueren zum basischen Bereich. Bei der Titration von Salzsäure ist dieser Übergang scharf. Wird mit Natronlauge Essigsäure titriert, so ist dieser Übergang eher fließend. Die Titration von starken und schwachen Säuren gibt unterschiedliche Titrationskurven.
Äquivalenzpunkt und Neutralpunkt Die Äquivalenzpunkte für beide Titrationen werden mit violetter Farbe eingetragen. Äquivalenzpunkt bedeutet, dass die Konzentrationen von Säure und Base gleich sind. Schauen wir uns nun diese Punkte an, grün markiert. Sie liegen da, wo die Titrationskurve einem ph-Wert von 7 entspricht. Diese Punkte bezeichnet man jeweils als Neutralpunkt. Bei der Titration der starken Säure Salzsäure mit der starken Säure Natronlauge sind Äquivalenzpunkt und Neutralpunkt gleich. Bei der Titration der Essigsäure sind Äquivalenzpunkt und Neutralpunkt verschieden.
Indikatoren Indikatoren müssen die Eigenschaft besitzen, dass sie ein auffälliges Verhalten im Umschlagbereich zeigen. Nehmen wir den Fall, wo Natronlauge mit Salzsäure titriert wird. Hier ist Methylorange ein populärer Indikator. In Natronlauge ist Methylorange gelb. Beim Erreichen des Äquivalenzpunktes schlägt der Indikator nach Rot um. Schauen wir uns den umgekehrten Fall an. Mit Natronlauge wird eine Salzsäurelösung titriert. Ein häufig verwendeter Indikator ist hierfür Phenolphthalein. Im Saueren des schwach basischen Bereichs ist Phenolphthalein weiß. Sobald ein leichter Überschuss der Base vorliegt, wird Phenolphthalein rosa. Vorsicht, bitte zu beachten! Bei der Wahl des Indikators ist der Äquivalenzpunkt entscheidend, nicht der Neutralpunkt. Das gilt es dann zu berücksichtigen, wenn man es mit schwachen Säuren oder Basen zu tun hat.
Gehaltsbestimmung Die Titration ist ein quantitatives Verfahren. Das heißt, man möchte mit ihrer Hilfe Mengen bestimmen. Hier nun zwei Anwendungsbeispiele: Mit Salzsäure wird eine Natronlaugelösung titriert. Man möchte nun gerne wissen, wie viel reines Natriumhydroxid in der Lösung enthalten sind. Die Salzsäurelösung soll eine Konzentration von 0,05 mol/l besitzen. Bei der Titration werden 15 ml Säure verbraucht. Die Stoffmenge n ist das Produkt aus Konzentration und Volumen. Wir multiplizieren beide Werte aus der Aufgabe. Wir erhalten für die Stoffmenge: n = 0,00075 mol. Der Gehalt ist nun die Masse reiner Natronlauge. Man erhält die Masse als Produkt aus der Stoffmenge und der molaren Masse. Wir multiplizieren die erhaltene Stoffmenge mit 40 g/mol. Wir erhalten: m = 0,03 g. Und nun ein Beispiel für die Titration von Salzsäure mit Natronlauge. Die Konzentration der Lauge beträgt 0,02 mol/l; 50 ml Lauge wird verbraucht. Wir errechnen zuerst die Stoffmenge: n = 0,02 mol/l × 0,05 l ; das ergibt 0,001 mol. Der Gehalt ergibt sich wieder als Produkt der Stoffmenge und molarer Masse. Man erhält: m = 0,0365 g.
Ich danke für eure Aufmerksamkeit. Alles Gute, auf Wiedersehen.
Säure-Base-Titration (Grundlagen) Übung
-
Definiere die Begriffe rund um Titration.
-
Bestimme folgende Punkte aus der Titrationskurve.
-
Berechne den Gehalt einer Natronlauge-Lösung.
-
Bestimme die Titrationskurve für die Maßanalyse von Oxalsäure mit Natronlauge.
-
Nenne einen geeigneten Indikator für die Titration von Essigsäure mit Natronlauge.
-
Erkläre, warum Rotkohl-Saft bei Zugabe von Säure die Farbe ändert.
9.360
sofaheld-Level
6.600
vorgefertigte
Vokabeln
7.729
Lernvideos
37.200
Übungen
32.432
Arbeitsblätter
24h
Hilfe von Lehrkräften

Inhalte für alle Fächer und Schulstufen.
Von Expert*innen erstellt und angepasst an die Lehrpläne der Bundesländer.
Testphase jederzeit online beenden
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation

 5 Minuten verstehen
5 Minuten verstehen
 5 Minuten üben
5 Minuten üben
 2 Minuten Fragen stellen
2 Minuten Fragen stellen









