Entropie – Einführung

in nur 12 Minuten? Du willst ganz einfach ein neues
Thema lernen in nur 12 Minuten?
-
 5 Minuten verstehen
5 Minuten verstehen
Unsere Videos erklären Ihrem Kind Themen anschaulich und verständlich.
92%der Schüler*innen hilft sofatutor beim selbstständigen Lernen. -
 5 Minuten üben
5 Minuten üben
Mit Übungen und Lernspielen festigt Ihr Kind das neue Wissen spielerisch.
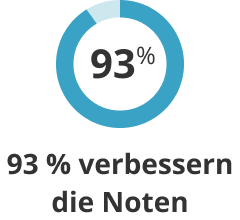
93%der Schüler*innen haben ihre Noten in mindestens einem Fach verbessert. -
 2 Minuten Fragen stellen
2 Minuten Fragen stellen
Hat Ihr Kind Fragen, kann es diese im Chat oder in der Fragenbox stellen.
94%der Schüler*innen hilft sofatutor beim Verstehen von Unterrichtsinhalten.
Grundlagen zum Thema Entropie – Einführung
Ich möchte mit euch in diesem Video über die Entropie sprechen. Der 1. Hauptsatz der Thermodynamik macht eine klare Aussage zur Energieerhaltung. Er gibt jedoch keine Information zur Richtung thermodynamischer Prozesse. Wir nähern uns dieser Frage über den „Energieverbrauch“, der physikalisch besser als Energieentwertung bzw. Dissipation bezeichnet wird. Eine wichtige Rolle bei der Beurteilung thermodynamischer Vorgänge spielen irreversible Prozesse. Das sind Prozesse, die nur in eine Richtung ablaufen. Die Entropie als Maß für die Energieentwertung können wir definieren, nachdem wir uns Klarheit über die Rolle der Temperatur verschafft haben. Es zeigt sich, dass die Entropie (nicht die Entropiedifferenz!) ein Maß für die Unordnung der Teilchen in einem System ist. Im letzten Abschnitt gebe ich eine Zusammenfassung. Viel Spaß!
Transkript Entropie – Einführung
Hallo und herzlich willkommen! In diesem Video geht es um die „Entropie - Einführung‟. Du kennst bereits thermodynamische Systeme. Nachher kennst Du die physikalische Größe „Entropie, die Begriffe „Energieentwertung“ und „Dissipation“, die Entropie als Maß für die Unordnung und Beispiele für die Vergrößerung der Entropie. Der Film besteht aus sieben Abschnitten: Erstens, Wiederholung: System und Gleichgewicht. Zweitens, Grenzen des ersten Hauptsatzes der Thermodynamik. Drittens, Energieverbrauch. Viertens, Irreversible Vorgänge. Fünftens, Entropie als quantitative Größe. Sechstens, Entropie und Ordnung. Siebtens, Zusammenfassung. Erstens, Wiederholung: System und Gleichgewicht. Ein thermodynamisches System ist durch bestimmte physikalische Größen gekennzeichnet, wie zum Beispiel den Druck, die Temperatur, das Volumen und die Energie. Das System kann in einen Austausch mit der Umgebung treten. Werden Energie und Materie ausgetauscht, so nennt man das System „offen“. Wird Energie ausgetauscht, Materie aber nicht, so nennt man das System „geschlossen“. Werden weder Energie noch Materie ausgetauscht, nennt man das System „abgeschlossen“ oder „isoliert“. Von besonderem Interesse sind die geschlossenen Systeme. Und zwar genau dann, wenn es weder Temperatur noch Druckveränderungen gibt. Man sagt dann, das thermodynamische System ist mit seiner Umgebung im Gleichgewicht. Zweitens, Grenzen des ersten Hauptsatzes der Thermodynamik. Der erste Hauptsatz der Thermodynamik ist ein „Energieerhaltungssatz“. Man kann sagen, Energie verschwindet nicht und entsteht nicht. Lediglich die Energieformen ändern sich. Zum Beispiel kann Wärme in innere Energie umgewandelt werden oder Arbeit in Wärme. Schauen wir uns einmal in einem geschlossenen System eine Wärmeübertragung an. Wir haben einen heißen und einen kalten Energiespeicher. Die Wärme wird von heiß zu kalt übertragen. Das lehrt die Erfahrung. Der umgekehrte Vorgang von kalt zu heiß wird nicht beobachtet. Die Wärmeübertragung von heiß zu kalt ist ein irreversibler Prozess. Nun treffen wir allerdings folgende Situation an: Der erste Hauptsatz der Thermodynamik macht keine Aussage über die Richtung der Energieübertragung. Drittens, Energieverbrauch. Sowohl für den Staubsauger als auch für das Haus gilt: Beide geben Energie in Form von Wärme Q an die Umgebung ab. Es findet eine quantitative Erhaltung von Energie, aber eine qualitative Veränderung statt. Diesen sogenannten „Energieverbrauch“ bezeichnet man in der Physik treffender. Und zwar als „Energieentwertung“ oder „Dissipation“, was „Energiestreuung“ bedeutet. Viertens, irreversible Vorgänge. Wir haben sie bereits erwähnt und in den Beispielen aus dem vorigen Abschnitt angedeutet. Hier nun möchten wir endgültige Klarheit schaffen. Ein Stückchen Knete befindet sich in gewisser Höhe über dem Boden. Gegenüber des Bodens besitzt es potentiell Energie. Es wird fallen gelassen. Die potentielle Energie nimmt ab, die kinetische Energie zu. Beim Aufprall auf den Boden wird ein Teil der mechanischen Energie in Wärme umgewandelt. Nun kann zwar mechanische Energie in Wärme umgewandelt werden, der umgekehrte Vorgang hingegen läuft nicht ab. Die Umwandlung mechanischer Energie in Wärmeenergie ist „irreversibel“. Der Vorgang ist irreversibel, das bedeutet unumkehrbar. Mitunter sagt man auch „spontan“. Es findet eine Energieentwertung statt. Eine „Energieaufwertung“ ist nicht möglich. Die Energieentwertung bringt zum Ausdruck, dass natürliche Vorgänge von selbst nur in eine Richtung ablaufen. Der Text ist aus einem Lehrbuch und ich möchte die Quelle angeben. Als Analogie zur Energieentwertung möchte ich den sogenannten „Wasserverbrauch“ anführen. Das Wasser wird verbraucht, entwertet. Aber nicht vernichtet. Fünftens, Entropie als quantitative Größe. Bei einem heißen Teekessel kommt es, in unserer Sprache, zur Energieentwertung. Es wird Wärme an die Umgebung abgegeben. Der Kessel soll die Masse m an Wasser enthalten und die Wärme Q an die Umgebung abgeben. Wenn er die Masse 2m an Wasser enthält, dann gibt er auch eine Wärme von 2Q an die Umgebung ab. Folglich: Energieentwertungen kann man addieren. Ich möchte nun einen Tauchsieder auf zweierlei Art verwenden. In beiden Fällen haben wir Energieentwertung. Einmal wird die Umgebung beheizt, die Energieentwertung ist groß. Dann erwärmen wir Wasser in einem Topf. Das Wasser wird heiß, die Energieentwertung ist gering. Die Energieentwertung ist umso größer, je niedriger die Temperatur des Systems ist, das die Energie aufnimmt. Der Zusammenhang wird als antiproportional angenommen. So und nun kommen wir zum Kern des Videos. Die Energieentwertung wird mit der Größe „Entropie S“ quantifiziert. In der Thermodynamik ist vor allem die Differenz Delta S von Interesse. Und wir wissen bereits: Erstens, Energieentwertungen sind additiv. Und zweitens, die Energieentwertung ist antiproportional zur Temperatur. Daraus ergibt sich für die Änderung der Entropie: Delta S = Q / T. Die Entropie S eines Systems nimmt um Delta S zu, beziehungsweise ab, wenn das System bei der Temperatur T die Wärme Q aufnimmt, beziehungsweise abgibt. Sechstens, Entropie und Ordnung. Betrachten wir einmal die Vermischung zweier Gase. Links ist die Entropie klein, rechts hoch. Die Entropie strebt zu einem Maximum. Das als Vorgeschmack auf den zweiten Hauptsatz der Thermodynamik. Wenn die Entropie steigt, vermischen sich die Teilchen, die Ordnung des Systems fällt. Das ist gleichlautend mit der Aussage, dass die Teilchen in Unordnung geraten. Die Entropie ist ein Maß für die Unordnung eines Systems. Achtung, das ist eine nicht völlig korrekte Faustregel. Kommen wir zur Einheit der Entropie. Die Einheit von S ergibt sich aus den Einheiten von Q und T und das sind „Joule“ und „Kelvin“. Die Einheit von S ist Joule pro Kelvin. Die Einheit der Entropie ist Joule pro Kelvin. Betrachten wir einmal die Aggregatzustände des Wassers. Wir vergleichen miteinander festes, flüssiges und gasförmiges Wasser. Die Angaben für die Entropie S sind jeweils in Joule pro Kelvin und zwar für ein Mol Wasser. Die Werte lauten 45, 70 und 189. Und die Unordnung der Teilchen nimmt tatsächlich von links nach rechts zu. Betrachten wir nun für verschiedene Stoffe die Entropie S in Joule pro Kelvin für jeweils ein Mol. Die natürlichen Modifikationen des Kohlenstoffs haben bemerkenswerte Eigenschaften. Diamant, zwei. Fast ideale Ordnung. Graphit, sechs. Immer noch recht große Ordnung. Kochsalz, noch fest, doch erheblich mehr mit 72. Benzol ist eine Flüssigkeit, die Ordnung ist geringer, 124. Erwartungsgemäß ist die Entropie beim Gas Sauerstoff am größten, 205. In der Regel ist die Entropie für einen Feststoff am kleinsten. Für Flüssigkeiten ist sie größer und noch größer für Gase. s heißt „solid“, auf Deutsch „fest“. l „liquid“, auf Deutsch „flüssig“. Und g steht für „gasförmig“. Das ist wieder eine Faustformel, Abweichungen sind möglich. Siebtens, Zusammenfassung: Wir haben eine neue physikalische Größe, die Entropie S eingeführt. Sie dient als Maß für die Energieentwertung und als Maß für die Unordnung der Teilchen im System. Die Energieentwertung wird durch die Entropieänderung Delta S bewertet. Als Maß für die Unordnung der Teilchen im System dient S selbst. Delta S = Q / T. Q ist die aufgenommene oder abgegebene Wärme, T die Temperatur. In der Regel ist die Entropie bei Feststoffen am niedrigsten, bei Flüssigkeiten höher und bei Gasen am größten. Die Entropie S strebt in abgeschlossenen Systemen zu einem Maximum. Hinweis auf den zweiten Hauptsatz der Thermodynamik.
Entropie – Einführung Übung
-
Fasse die Grundlagen zu Systemen und Gleichgewichten zusammen.
-
Gib an, wieso die Größe der Entropie zur Beschreibung thermodynamischer Systeme eingeführt wurde.
-
Vergleiche die Entropien verschiedener Stoffe miteinander.
-
Berechne die Entropieänderung beim Schmelzen von Eiswürfeln.
-
Vergleiche die Entropien S von einem Stoff in verschiedenen Aggregatszuständen miteinander.
-
Ermittle die Menge des Eises, die in diesem Beispiel geschmolzen wurde.
9.317
sofaheld-Level
6.600
vorgefertigte
Vokabeln
7.722
Lernvideos
37.189
Übungen
32.420
Arbeitsblätter
24h
Hilfe von Lehrkräften

Inhalte für alle Fächer und Schulstufen.
Von Expert*innen erstellt und angepasst an die Lehrpläne der Bundesländer.
Testphase jederzeit online beenden
Beliebteste Themen in Physik
- Temperatur
- Schallgeschwindigkeit
- Dichte
- Drehmoment
- Transistor
- Lichtgeschwindigkeit
- Elektrische Schaltungen – Übungen
- Galileo Galilei
- Rollen- Und Flaschenzüge Physik
- Radioaktivität
- Aufgaben zur Durchschnittsgeschwindigkeit
- Lorentzkraft
- Beschleunigung
- Gravitation
- Ebbe und Flut
- Hookesches Gesetz Und Federkraft
- Elektrische Stromstärke
- Elektrischer Strom Wirkung
- Reihenschaltung
- Ohmsches Gesetz
- Freier Fall
- Kernkraftwerk
- Was sind Atome
- Aggregatzustände
- Infrarot, Uv-Strahlung, Infrarot Uv Unterschied
- Isotope, Nuklide, Kernkräfte
- Transformator
- Lichtjahr
- Si-Einheiten
- Fata Morgana
- Gammastrahlung, Alphastrahlung, Betastrahlung
- Kohärenz Physik
- Mechanische Arbeit
- Schall
- Schall
- Elektrische Leistung
- Dichte Luft
- Ottomotor Aufbau
- Kernfusion
- Trägheitsmoment
- Heliozentrisches Weltbild
- Energieerhaltungssatz Fadenpendel
- Linsen Physik
- Ortsfaktor
- Interferenz
- Diode und Photodiode
- Wärmeströmung (Konvektion)
- Schwarzes Loch
- Frequenz Wellenlänge
- Elektrische Energie

 5 Minuten verstehen
5 Minuten verstehen
 5 Minuten üben
5 Minuten üben
 2 Minuten Fragen stellen
2 Minuten Fragen stellen



















Hallo Thão-Mai, in der Schule ist es ja oft so, dass Themen von Klassenstufe zu Klassenstufe wiederholt und dabei vertieft werden – und oft eben auch komplizierter. Das hier ist ein Video für höhere Klassen, da die beiden Hauptsätze der Thermodynamik und der Begriff der Entropie erst in höheren Klassen behandelt werden. Aber natürlich kommen dort auch Begriffe vor, die du schon in der 7. Klasse lernst wie Wärme und Temperatur.