Universelle Gasgleichung

in nur 12 Minuten? Du willst ganz einfach ein neues
Thema lernen in nur 12 Minuten?
-
 5 Minuten verstehen
5 Minuten verstehen
Unsere Videos erklären Ihrem Kind Themen anschaulich und verständlich.
92%der Schüler*innen hilft sofatutor beim selbstständigen Lernen. -
 5 Minuten üben
5 Minuten üben
Mit Übungen und Lernspielen festigt Ihr Kind das neue Wissen spielerisch.
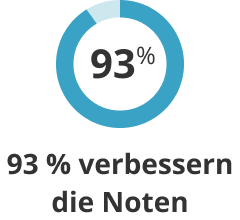
93%der Schüler*innen haben ihre Noten in mindestens einem Fach verbessert. -
 2 Minuten Fragen stellen
2 Minuten Fragen stellen
Hat Ihr Kind Fragen, kann es diese im Chat oder in der Fragenbox stellen.
94%der Schüler*innen hilft sofatutor beim Verstehen von Unterrichtsinhalten.
Grundlagen zum Thema Universelle Gasgleichung
In diesem Video lernst du die universelle Gasgleichung kennen. Dazu wird dir zuerst erklärt, was ein ideales Gas überhaupt ist und welches die wichtigsten Größen für Gase sind. Im Anschluss zeigt das Video, welche Beziehungen zwischen den Zustandsgrößen (Druck, Temperatur, Volumen) auftreten und wie man die Gasgleichung herleitet. Zum Schluss geht es dann noch um die universelle Gaskonstante und um Zustandsdiagramme (zwei- und dreidimensional).
Transkript Universelle Gasgleichung
Hallo und herzlich willkommen! Das Video heißt "Die universelle Gasgleichung". Du kennst die Zustandsgrößen Druck, Volumen und Temperatur und ihre Einheiten. Nachher kennst du die Avogadro-Konstante, die universelle Gaskonstante, die universelle Gasgleichung und Darstellungen der Zustandsdiagramme. Der Film besteht aus sieben Abschnitten. 1. Das ideale Gas. 2. Wichtige Größen für Gase. 3. Beziehungen zwischen den Zustandsgrößen. 4. Herleitung der Gasgleichung. 5. Die universelle Gaskonstante R. 6. Zweidimensionale Zustandsdiagramme und 7. Dreidimensionale Zustandsdiagramme. 1. Das ideale Gas: Das ideale Gas sollte in der Thermodynamik zwei Bedingungen genügen: Die Teilchen des Gases sollten auf keinen Fall groß sein, sondern eher klein. Am besten so klein, dass man ihre Größe vernachlässigen kann. Anders gesagt, das Volumen der Teilchen ist praktisch null. Als Zweites sollten zwischen den Teilchen keine Kräfte wirken. Exakter gesprochen, zwischen den Teilchen finden nur elastische Stöße statt. Das heißt, die Zusammenstöße führen nicht zu einem Verlust von kinetischer Energie. Die meisten gängigen Gase wie Wasserstoff, Sauerstoff oder Stickstoff erfüllen diese Bedingungen. 2. Wichtige Größen für Gase: Um den Zustand eines Gases zu charakterisieren, benutzt man sogenannte "Zustandsgrößen". Das sind der Druck (p), das Volumen (V) und die Temperatur (T). Die SI-Einheit des Drucks ist Newton pro Quadratmeter (N/m2). Man sagt auch Pascal, abgekürzt (Pa). Die SI-Einheit des Volumens ist m3, Kubikmeter. Die Einheit der absoluten Temperatur (T) ist K, Kelvin. 3. Beziehungen zwischen den Zustandsgrößen: Bei der Herleitung im Video stützen wir uns auf experimentelle Befunde: 1.) Das Gesetz von Gay-Lussac: Es besagt, dass das Volumen eines Gases proportional zu seiner Temperatur ist. Vorausgesetzt wird, der Druck ist konstant. 2.) Das Gesetz von Amontons: Der Druck p ist proportional zur Temperatur unter der Bedingung, dass das Volumen V konstant ist. Das Gesetz von Boyle Mariotte: Auf dem Bild links sehen wir Boyle. Das Gesetz besagt, dass das Volumen des Druckes p mit dem Volumen V eines Gases konstant ist. Bedingung, die Temperatur T ist ebenfalls konstant. 4. Herleitung der Gasgleichung: Berücksichtigen wir beim Gesetz von Boyle Mariotte die beiden ersten Gesetze, so stellen wir fest, dass das Produkt vom Druck P und dem Volumen V proportional zur Temperatur T sein muss. Wir schreiben p * V = K * T. K ist ein Proportionalitätsfaktor. Wir formen um p * V/T = K. Wir unterstellen, dass K abhängig von der Teilchenzahl N ist, denn je mehr Teilchen, umso mehr Volumen. Das klingt nun einmal logisch. Den exakten Zusammenhang liefert das Gesetz von Avogadro: Gleiche Gasvolumina enthalten die gleiche Anzahl an Teilchen. Das stimmt genau unter der Voraussetzung, dass Druck p und Temperatur T unverändert bleiben. Ich kann nun mit Sicherheit schreiben p * V/T ist proportional zur Teilchenzahl N. Und weiter: p V/T = K * N. Der Proportionalitätsfaktor k ist die berühmte Boltzmann-Konstante. Die Gleichung p * V/T = K * N ist nicht schlecht. Was hier stört, ist die Veränderlichkeit von N. Aus der Chemie wissen wir N/n = NA n ist die Stoffmenge in Mol. Und NA ist eine weitere Konstante, die Avogadro-Konstante. Die Avogadro-Konstante kennen die meisten von euch auswendig: 6,0231023 mol-1. So viel Teilchen sind in einem Mol Stoff enthalten. Wir stellen um: N = n * NA. Wir erhalten: p * V/T = k NA * n. Das Produkt aus Boltzmann-Konstante k und Avogadro-Konstante NA wird als R, universelle Gaskonstante definiert. Also ergibt sich p * V/T als Produkt aus R * n. Wir multiplizieren mit p: p * V = R * n * T. Als Lehrformel findet man häufig R und n vertauscht. Also endgültig: p * V = n * R * T. Der Druck ist hier p, die Temperatur ist hier T, das Volumen ist V, die Stoffmenge ist n in Mol, die universelle Gaskonstante ist R. Welche Einheit hat sie? Die universelle Gaskonstante R, wir erinnern uns: p V = R * n * T. Umgestellt nach R = (p * V) / (n * T). Es sollen streng die Einheiten des SI-Systems benutzt werden: p = N/m2, V = m3, n = mol, T = K. Wir bestimmen nun die Einheit von R: Newton pro Quadratmeter, Kubikmeter und in den Nenner noch Mol und Kelvin (R = (Nm3)/(m2molK)). m3 wird gegen m2 gekürzt. Es verbleibt Nm/(molK). Wichtig und gut ist nun zu wissen: 1 Newtonmeter ist gleich 1 Joule (1 Nm = 1 J). Die Einheit der Gaskonstante ist somit J/(mol*K). Durch Messungen erhält man R = 8,314J * mol-1 * K-1. Die Gaskonstante R ist eine Naturkonstante. 6. Zweidimensionale Zustandsdiagramme: Wir notieren die universelle Gasgleichung: p * V = R * n * T. Für die graphische Darstellung soll das Produkt aus R und n konstant sein. Für R ist diese Bedingung erfüllt. Für die Stoffmenge wird häufig 1 mol angenommen. Also p * V/T = konstant. Wir haben nun drei Variablen p, V und T. Der funktionelle Zusammenhang ist in ebener Darstellung nicht möglich. Der Ausweg besteht darin, eine Variable festzuhalten, das heißt, sie konstant zu machen. Also, entweder p = konst oder V = konst oder T = konst. Das Oder ist hier ausschließend. Wir wollen das einmal veranschaulichen: p = konst, V = konst und der dritte Fall T = konst. Im ersten Fall sagt man, der Zustand des Gases ist isobar. Bei der Konstanz des Volumens sagt man isochor. Bleibt die Temperatur gleich, so sagt man, der Zustand des Gases ist isotherm. Man erhält nun aus der Gasgleichung: Bei konstantem Druck ist der Quotient aus V und T konstant. Ist das Volumen konstant, so ist der Quotient aus p und T ebenfalls konstant. Bleibt die Temperatur unverändert, dann ist das Produkt aus Druck p und Volumen V konstant. So, jetzt ist es gut, wenn man die 6. Klasse nicht übersprungen hat und noch Erinnerungen daran besitzt. Bei p konstant sind V und T proportionale Größen. Das Gleiche gilt bei V konstant für p und T. Ist T konstant, sind p und V antiproportional. Wir wollen nun die Abhängigkeit der nicht konstanten Zustandsgrößen in den drei Fällen graphisch darstellen. Links wird V als Funktion von T abgetragen. Da die Größen proportional sind, handelt es sich um eine Gerade, die durch den Ursprung geht. Der funktionale Zusammenhang zwischen p und T wird ebenfalls durch eine Gerade dargestellt. Der Zusammenhang von p und V sieht in der graphischen Darstellung so aus. Die Kurve ist eine Hyperbel. Der Vorteil der zweidimensionalen Darstellung ist die Übersichtlichkeit. Der Nachteil, eine Variable muss konstant gelassen werden. 7. Dreidimensionale Zustandsdiagramme: Hier ist ein Beispiel für ein dreidimensionales Zustandsdiagramm. Erzeugt habe ich es mit NetPlot. Dargestellt wird der Zusammenhang. p = 8,314 * T/V. Für n = 1 mol. In mathematischer Schreibweise: z = 8,314 * x/y. Ich möchte euch helfen, euch in der linken Darstellung zurechtzufinden. Nach oben wird z abgetragen, also der Druck p. Der Bereich geht bis 100000 N/m2. Die Achse schräg nach vorne ist x, die Temperatur. Sie überstreicht den Bereich von 0 bis 800 Kelvin. Die verbleibende Achse ist y, also V von 0 bis 10 m3. Der Vorteil dieser Darstellung ist klar. Es wird der Zusammenhang von p, T und V perspektivisch dargestellt. Der Nachteil fällt auch ins Auge. In der Ebene ist die dreidimensionale Darstellung unübersichtlich. Das war ein weiteres Video von André Otto. Ich wünsche euch alles Gute und viel Erfolg. Tschüss!
Universelle Gasgleichung Übung
9.244
sofaheld-Level
6.600
vorgefertigte
Vokabeln
7.669
Lernvideos
37.113
Übungen
32.360
Arbeitsblätter
24h
Hilfe von Lehrkräften

Inhalte für alle Fächer und Schulstufen.
Von Expert*innen erstellt und angepasst an die Lehrpläne der Bundesländer.
Testphase jederzeit online beenden
Beliebteste Themen in Physik
- Temperatur
- Schallgeschwindigkeit
- Dichte
- Drehmoment
- Transistor
- Lichtgeschwindigkeit
- Galileo Galilei
- Rollen- Und Flaschenzüge Physik
- Radioaktivität
- Lorentzkraft
- Beschleunigung
- Gravitation
- Ebbe und Flut
- Hookesches Gesetz Und Federkraft
- Elektrische Stromstärke
- Elektrischer Strom Wirkung
- Reihenschaltung
- Ohmsches Gesetz
- Freier Fall
- Kernkraftwerk
- Was sind Atome
- Aggregatzustände
- Infrarot, Uv-Strahlung, Infrarot Uv Unterschied
- Isotope, Nuklide, Kernkräfte
- Transformator
- Lichtjahr
- Si-Einheiten
- Fata Morgana
- Gammastrahlung, Alphastrahlung, Betastrahlung
- Kohärenz Physik
- Mechanische Arbeit
- Schall
- Schall
- Elektrische Leistung
- Dichte Luft
- Ottomotor Aufbau
- Kernfusion
- Trägheitsmoment
- Heliozentrisches Weltbild
- Energieerhaltungssatz Fadenpendel
- Linsen Physik
- Ortsfaktor
- Interferenz
- Diode und Photodiode
- Wärmeströmung (Konvektion)
- Schwarzes Loch
- Frequenz Wellenlänge
- Elektrische Energie
- Parallelschaltung
- Dopplereffekt, Akustischer Dopplereffekt

 5 Minuten verstehen
5 Minuten verstehen
 5 Minuten üben
5 Minuten üben
 2 Minuten Fragen stellen
2 Minuten Fragen stellen


















